Table of Contents
Solution and it’s concept
दो या दो से अधिक पदार्थों से मिलकर बना समांगी मिश्रण विलयन कहलाता है। उदाहरण के लिए चीनी पानी का घोल।
Solute(विलेय):- विलयन में कम मात्रा में उपस्थित पदार्थ को विलेय कहा जाता है। उदाहरण के लिए, चीनी पानी के विलियन में चीनी विलेय होता है।
Solvent(विलायक):- विलयन में अधिक मात्रा में उपस्थित पदार्थ को विलायक कहते हैं। उदाहरण के लिए, चीनी पानी के विलयन में पानी विलायक होता है।
Unit of expression for Solutions(विलयनों को व्यक्त करने की इकाई):-
विलयनों को व्यक्त करने के निम्नलिखित इकाई होती है:-
1. Mole fraction(मोल प्रभाज):- किसी विलयन के एक अवयव के मोलो की संख्या तथा विलयन में उपस्थित कुल मोलों की संख्या के अनुपात को मोल अंश या मोल प्रभाज कहा जाता है। इसे X के द्वारा सूचित किया जाता है।
2. Molality(मोललता):- प्रति किलोग्राम विलायक में उपस्थित भी विलेय के मोलो की संख्या को मोललता कहा जाता है। इसे m से सूचित किया जाता है इसका इकाई molal होता है।
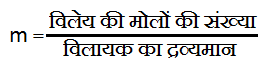
3. Molarity(मोलरता):- एक लीटर विलयन में उपस्थित विलेय के मोलो की संख्या को मोलरता कहा जाता है। इसे M से सूचित किया जाता है। इसकी इकाई molar होती है।
4. Percentage of volume(आयतन प्रतिशत):- किसी विलयन के अवयव का आयतन तथा कुल विलयन अनुपात प्रतिशत में हो, तो वह आयतन प्रतिशत कहलाता है।
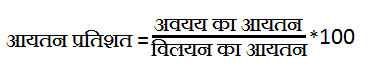
5. Percentage of Mass(द्रव्यमान प्रतिशत):- प्रति 100 ग्राम विलयन में उपस्थित किसी घटक की द्रव्यमान उसकी द्रव्यमान प्रतिशत कहलाती है।
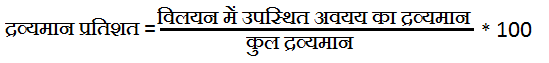
PPM(parts per million):- विलयन के प्रति दस लाख द्रव्यमान भागों में उपस्थित किसी घटक का द्रव्यमान भागों की संख्या उसकी ppm कहलाती है।
Henry’s Law:-
इस नियम के अनुसार की स्थिर ताप पर गैस का आंशिक दाब (बाह्य अवस्था) P उस विलयन के गैस के मोल अंश के समानुपाती होता है।
m ∝ p
m = K•P
हेनरी नियम के कुछ अनुप्रयोग: –
1. शीतल की पेय अथवा सोडा वाटर में CO की विलेयता बढ़ाने के लिए बोतल को उच्च दाब पर बंद किया जाता है ।
2. गहरे समुंद्र में गोताखोर को उच्च दाब की वायु में सांस लेना पड़ता है अतः उच्च दबपर वायु में उपस्थित है N तथा O की रक्त में विलेयता अधिक हो जाती है जो रक्त के प्रवाह को प्रभावित करती है परिणाम स्वरूप गोताखोर को बहुत पीड़ा होती है इसी अवस्था को बैंड कहते हैं बैंड से बचने के लिए गोताखोर के गैस सिलेंडर में हिलियम गैस मिलाया जाता है।
Vapour pressure(वाष्पदाब):-
किसी द्रव्य को गैस बनाने में जो दाब लगती है उसे वाष्पदाब कहते है। वाष्प दाब निम्नलिखित बातों पर निर्भर करता है: –
1. वस्तु की प्रकृति
2. ताप
3. अवाष्पशील पदार्थ
Rault ‘s Law:-
किसी द्रव्य विलयन में प्रत्येक द्रव का आंशिक दाब उसके विलयन के मोल अंश के समानुपाती होता है।
PA ∝ XA
Ideal solutions(आदर्श विलयन):-
वह विलयन जो राउल्ट के नियम का पालन करता है उसे आदर्श विलयन कहते हैं।
आदर्श विलयन के निम्नलिखित गुण है:-
1. सभी ताप, संद्रताओं पर राउल्ट के नियम का पालन करना चाहिए।
2. आयतन में परिवर्तन शून्य होना चाहिए।
3. Enthalpy परिवर्तन शून्य होना चाहिए।
4. विलेय और विलायक की प्रकृति समान होने पर विलयन आदर्श हो जाता है।
Non- ideal solutions(अनादर्श विलयन):-
वह विलयन जो राउल्ट के नियम का पालन नहीं करता है उसे अनादर्श विलयन कहते हैं।
अनादर्श विलयन के गुण:-
1. यह राउल्ट के नियम का पालन नही करता है।
2. आयतन में परिवर्तन शून्य नही होता है।
3. Enthalpy परिवर्तन शून्य नही होना चाहिए।
4. इसमें विलेय और विलायक की प्रकृति कभी विलयन के समान नहीं होती है।
Colligative properties(अणुसंख्य गुणधर्म):-
वे सभी गुणधर्म जो विलयन में उपस्थित कुल कणों की संख्या पर निर्भर करता है ना की उसके प्रकृति पर, अणुसंख्य गुणधर्म कहलाता है।
अणुसंख्य गुणधर्म के चार प्रकार होते है:-
1. वाष्पदाब में आपेक्षिक अवनमन:-
किसी विलयन में अवाष्पशील विलायक मिलाने पर उसके वष्पदाब में कमी आती है जिसे वाष्पदाब का अवनमन कहा जाता है।
2. क्वथनांक में उन्नयन: –
किसी द्रव्य का क्वथनांक बिंदु वह ताप है जिस पर उसका वाष्प दाब वायुमंडलीय दाब के बराबर आ जाता है।
जब किसी अवाष्पशील पदार्थ को किसी द्रव्य में मिलाया जाता है तो द्रव्य के वाष्पदाब में कमी आती है अतः विलयन का वाष्प दाब वायुमंडलीय दाब के बराबर होने में अधिक ताप की आवश्यकता होती है अर्थात विलयन का क्वथनांक शुद्ध विलायक की तुलना में बढ़ जाता है इसे क्वथानंक का उन्नयन कहते हैं।
3. हिमांक में अवनमन:-
किसी पदार्थ का हिमांक वह तापमान है जिस पर द्रव्य अवस्था का वष्पदाब ठोस अवस्था के वाष्पदाब के बराबर हो जाता है अर्थात एक विलयन तभी हिमीकरण होता है जब उसका वाष्प दाब ठोस विलायक वाष्प दाब के बराबर हो जाता है। हिमांक में कमी को हिमांक का अवनमन कहते है।
4. परासरण:-
विलायक का अपने उच्च सांद्रता से निम्न सांद्रता की ओर अर्ध पारगम्य झिल्ली द्वारा गमन परासरण कहलाता है।
परासरण दाब:- वह दाब जो परासरण की क्रिया को रोक देता है उसे परासरण दाब कहते हैं। परासरण दाब, ताप एवं सांद्रता के समानुपाती होता है।
Vant Hoff factor:-
वैसे गुणांक जो प्रेक्षित अणुसंख्य गुणधर्म और सामान्य अणुसंख्य गुणधर्म को बताता है वह वांट हाफ गुणांक कहलाता है। इसे i से सूचित करते हैं।



Thanks for making easy language 🙏🙏
Dear mimprovement.com administrator, Your posts are always thought-provoking and inspiring.
Dear mimprovement.com administrator, Your posts are always well presented.